juan jose rodriguez y jacobo correa 10-02
ley de boyle
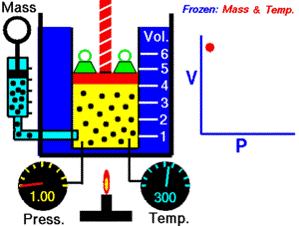
es una ley de los gases experimental que describe cómo la presión de un gas tiende a disminuir a medida que el volumen de un gas aumenta
La ecuación establece que el producto de la presión y el volumen es una constante para una masa dada de gas confinado, siempre y cuando la temperatura es constante
preion 1 por volumen 1 es igual a presion 2 por volumen 2
el volumen es inversamente proporciona a la presion
ley de charles
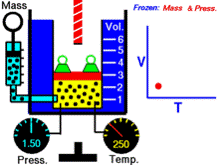
La ley de Charles, es una de las leyes de los gases. Relaciona el volumen y la temperatura de una cierta cantidad de gas ideal, mantenida a una presión constante, mediante una constante de proporcionalidad directa.
Esta ley dice que para una cierta cantidad de gas a una presión constante, al aumentar la temperatura, el volumen del gas aumenta y al disminuir la temperatura, el volumen del gas disminuye. Esto se debe a que la temperatura está directamente relacionada con la energía cinética(debido al movimiento) de las moléculas del gas. Así que, para cierta cantidad de gas a una presión dada, a mayor velocidad de las moléculas (temperatura), mayor volumen del gas.

ley de gay lussac
Establece que la presión de un volumen fijo de un gas, es directamente proporcional a su temperatura.
· Si el volumen de una cierta cantidad de gas a presión moderada se mantiene constante, el cociente entre presión y temperatura (Kelvin) permanece constante:


ley combinada de llos gases
La ley combinada de los gases o ley general de los gases es una ley de los gases que combina la ley de Boyle, la ley de Charles y la ley de Gay-Lussac. Estas leyes matemáticamente se refieren a cada una de las variables termodinámicas con relación a otra mientras todo lo demás se mantiene constante. La ley de Charles establece que el volumen y la temperatura son directamente proporcionales entre sí, siempre y cuando la presión se mantenga constante. La ley de Boyle afirma que la presión y el volumen son inversamente proporcionales entre sí a temperatura constante. Finalmente, la ley de Gay-Lussac introduce una proporcionalidad directa entre la temperatura y la presión, siempre y cuando se encuentre a un volumen constante. La interdependencia de estas variables se muestra en la ley de los gases combinados, que establece claramente que:
La relación entre el producto presión-volumen y la temperatura de un sistema permanece constante.
